Nanotechnologia w leczeniu miażdżycy wyznacza nowy kierunek rozwoju współczesnej kardiologii. W 2026 roku obserwujemy moment, w którym koncepcje znane dotąd głównie z laboratoriów zaczynają realnie wkraczać do badań klinicznych. Dzięki nanocząstkom lekarze mogą dostarczać leki bezpośrednio do blaszki miażdżycowej, a więc dokładnie tam, gdzie rozwija się choroba.
Dotychczasowa farmakoterapia działała ogólnoustrojowo. Owszem, obniżała poziom cholesterolu i zmniejszała stan zapalny, jednak jednocześnie obciążała wątrobę i inne narządy. Tymczasem podejście oparte na nanotechnologii pozwala zmienić logikę leczenia – z szerokiego oddziaływania na precyzyjne uderzenie w źródło problemu.
Przeczytaj także: Szczepionki przeciw grypie nowej generacji z rekordowym wsparciem UE
Czym jest nanotechnologia w leczeniu miażdżycy?
Nanotechnologia operuje strukturami o wielkości od 1 do 100 nanometrów. Dla porównania, są to rozmiary porównywalne z wirusami i dużymi białkami. W praktyce oznacza to możliwość konstruowania mikroskopijnych nośników leków zdolnych do przenikania przez bariery biologiczne.
W kardiologii nanocząstki pełnią rolę inteligentnych transporterów. Po wprowadzeniu do krwiobiegu krążą w organizmie, aż dotrą do miejsca objętego stanem zapalnym. Co istotne, ich powierzchnię można modyfikować w taki sposób, aby rozpoznawały określone komórki, na przykład makrofagi obecne w blaszce miażdżycowej.
W efekcie leczenie przestaje być przypadkowe. Substancja czynna trafia tam, gdzie jest potrzebna, a zdrowe tkanki pozostają w znacznie mniejszym stopniu narażone na działanie leku.
Jak działa celowana terapia miażdżycy?
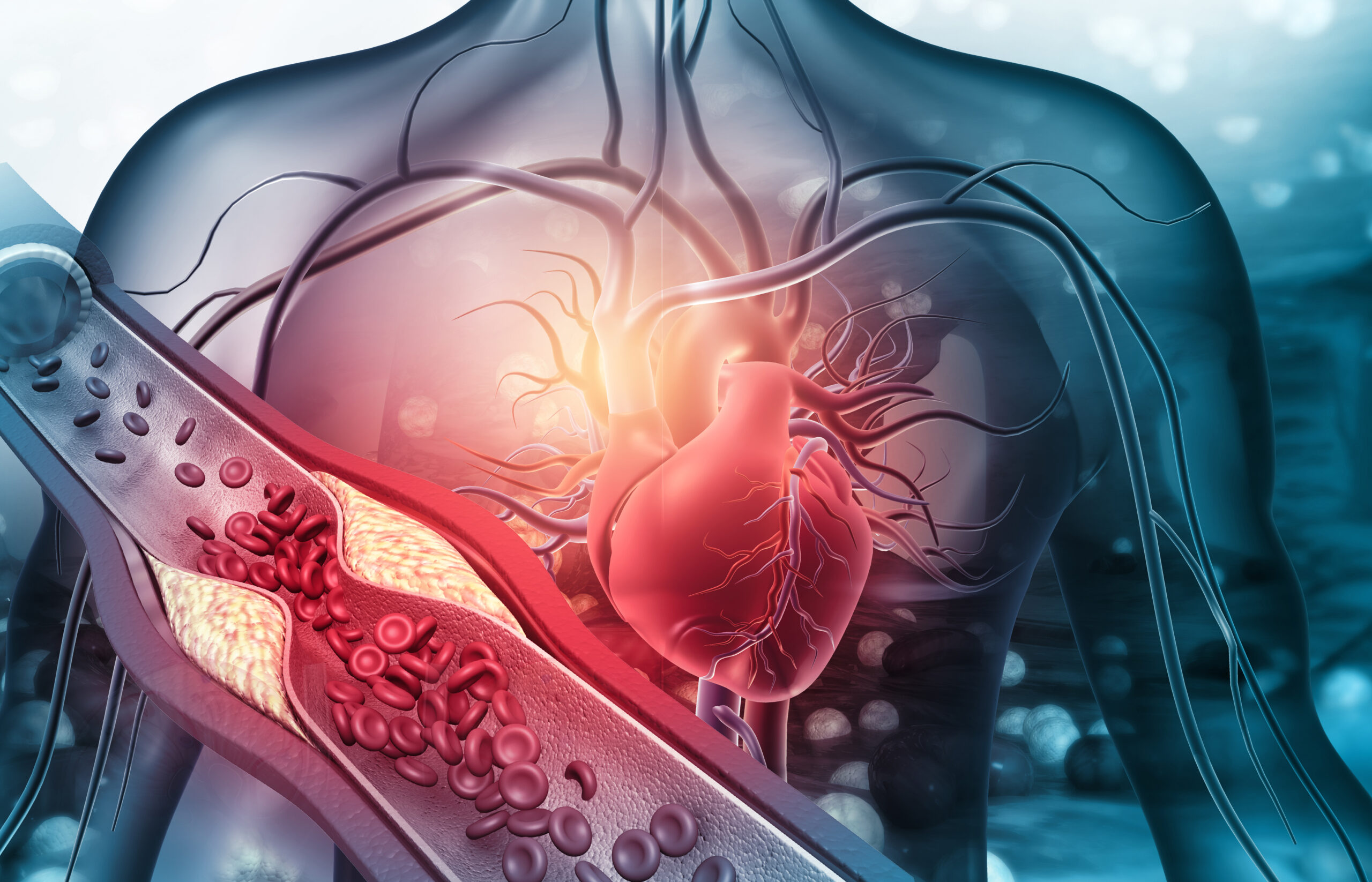
Proces miażdżycowy to przewlekły stan zapalny prowadzący do odkładania się lipidów i tworzenia blaszek w ścianach tętnic. To właśnie te zmiany odpowiadają za zawały serca i udary mózgu. Dlatego celem terapii staje się stabilizacja lub redukcja blaszki.
W praktyce wykorzystuje się dwa mechanizmy działania.
Pierwszy to celowanie pasywne. W obszarach zapalnych naczynia krwionośne stają się bardziej przepuszczalne. Dzięki temu nanocząstki łatwiej przenikają do chorej tkanki i tam się kumulują.
Drugi mechanizm to celowanie aktywne. W tym przypadku powierzchnię nanocząstek wyposaża się w ligandy – przeciwciała lub peptydy – które wiążą się ze specyficznymi receptorami na komórkach tworzących blaszkę. Takie rozwiązanie zwiększa precyzję terapii i minimalizuje straty „po drodze”.
Co więcej, nanonośniki mogą transportować różne substancje: statyny, leki przeciwzapalne, czynniki rozpuszczające lipidowy rdzeń blaszki, a nawet cząsteczki RNA modulujące ekspresję genów. Tym samym pojawia się realna szansa nie tylko na spowolnienie, lecz także częściową regresję zmian miażdżycowych.
Rodzaje nanocząstek w badaniach klinicznych 2026
Rozwój inżynierii materiałowej sprawił, że w 2026 roku testuje się kilka zaawansowanych platform nanotechnologicznych. Każda z nich ma inne właściwości, dlatego może odpowiadać na odmienne potrzeby kliniczne.
Liposomy – biokompatybilne nośniki
Liposomy zbudowane są z podwójnej warstwy lipidowej, która przypomina naturalne błony komórkowe. Dzięki temu organizm dobrze je toleruje. Ponadto umożliwiają transport zarówno leków rozpuszczalnych w wodzie, jak i w tłuszczach.
W badaniach nad miażdżycą wykorzystuje się je do dostarczania wysokich dawek statyn bezpośrednio do makrofagów w blaszce. Wczesne wyniki sugerują, że taka forma terapii może skutecznie ograniczać progresję choroby przy mniejszym ryzyku działań ubocznych.
Nanocząstki polimerowe – kontrolowane uwalnianie
Z kolei nanocząstki polimerowe, wytwarzane z biodegradowalnych materiałów takich jak PLGA, pozwalają kontrolować tempo uwalniania leku. Dzięki temu terapia może działać dłużej i bardziej stabilnie.
Szczególne nadzieje wiąże się z wykorzystaniem ich w terapii genowej. Nanonośniki dostarczające siRNA mogą wyciszać geny odpowiedzialne za proces zapalny w tętnicach. W efekcie leczenie nie ogranicza się wyłącznie do objawów, lecz ingeruje w mechanizmy molekularne choroby.
Nanocząstki nieorganiczne – terapia i diagnostyka w jednym
Odrębny kierunek stanowią nanocząstki złota oraz superparamagnetyczne nanocząstki tlenku żelaza. Ich właściwości fizyczne pozwalają łączyć diagnostykę z terapią, czyli stosować podejście teranostyczne.
Nanocząstki tlenku żelaza mogą działać jako środek kontrastowy w rezonansie magnetycznym, co umożliwia identyfikację niestabilnych blaszek. Z kolei cząstki złota, po nagromadzeniu w zmianie, mogą zostać aktywowane światłem, generując ciepło stabilizujące blaszkę i zmniejszające ryzyko jej pęknięcia.
Korzyści nanotechnologii w leczeniu miażdżycy
Zastosowanie nanocząstek przynosi szereg potencjalnych korzyści:
- zwiększenie skuteczności dzięki wysokiemu stężeniu leku w miejscu choroby
- ograniczenie działań niepożądanych w innych narządach
- stabilizacja niestabilnych blaszek, a więc redukcja ryzyka zawału
- możliwość łączenia diagnostyki i terapii w jednym procesie
Co istotne, takie podejście może zmienić model opieki nad pacjentami z wysokim ryzykiem sercowo-naczyniowym.
Uzupełnieniem leczenia i profilaktyki może być wsparcie specjalistów, takich jak fizjoterapeuci – szczególnie jeśli interesuje Cię profesjonalna fizjoterapia w Poznaniu ukierunkowana na poprawę wydolności i krążenia.
Wyzwania i przyszłość terapii
Mimo obiecujących wyników droga do rutynowego stosowania nanoterapii pozostaje wymagająca. Przede wszystkim konieczne jest dokładne zbadanie bezpieczeństwa długoterminowego. Organizm musi skutecznie metabolizować i usuwać nanocząstki, a ich obecność nie może wywoływać reakcji immunologicznych.
Ponadto produkcja na dużą skalę wymaga spełnienia rygorystycznych norm farmaceutycznych. Proces rejestracyjny w instytucjach takich jak Europejska Agencja Leków jest długotrwały, jednak zapewnia pacjentom najwyższy poziom bezpieczeństwa.
Jednak mimo tych wyzwań kierunek rozwoju wydaje się jednoznaczny. Nanotechnologia w leczeniu miażdżycy oferuje precyzję, której dotąd brakowało w terapii chorób serca. Jeśli badania kliniczne potwierdzą jej skuteczność, w nadchodzących latach możemy być świadkami prawdziwej rewolucji w kardiologii.
Warto również pamiętać o zdrowiu jamy ustnej, dlatego konsultacja u specjalisty, takiego jak ortodonta we Wrocławiu, może stanowić element szerszej profilaktyki zdrowotnej.







Leave a Reply